Potenziale chimico
Febbraio 1st, 2022 | by Marcello Colozzo |
Ricordiamo velocemente che il primo principio della termodinamica per un processo reversibile di un sistema termodinamico che compie lavoro meccanico attraverso le forze di pressione, si scrive in forma differenziale

dove: U è l'energia interna, S è l'entropia, P è la pressione, V è il volume. Infatti, per un processo reversibile la quantità di calore scambiata è
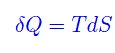
per cui matematicamente, 1/T è un fattore integrante che trasforma dQ in un differenziale esatto cioè in dS. Di contro, per un processo irreversibile
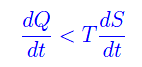
ovvero l'entropia aumenta indipendentemente dalla quantità di calore assorbita dal sistema. Ciò implica l'inequazione di Clausius:
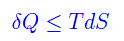
ove il segno di uguale sussiste solo per i processi reversibili. Dalla equazione più sopra:
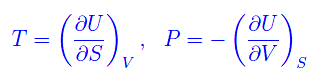
Cioè l'energia interna U(S,V) si comporta alla stregua di un potenziale rispetto alle variabili S,V. Ricordamo che l'entalpia (o funzione termica) è definita
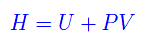
per cui
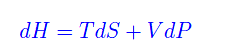
Quindi
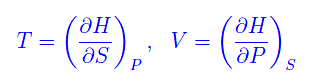
Pertanto l'entalpia è un potenziale rispetto alle variabili S,P. Abbiamo poi l'energia libera
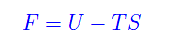
il cui differenziale totale è
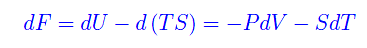
Si tratta dunque di un potenziale rispetto alle variabili V,T:
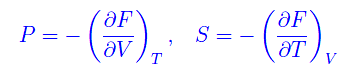
Rimangono le variabili P,T. Per definire un potenziale rispetto a esse, scriviamo
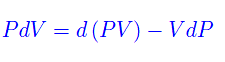
che sostituita nella eq. precedente
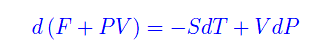
Pertanto definiamo il potenziale termodinamico
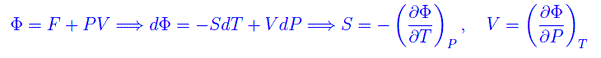
Le grandezze H,F,Φ sono additive, esattamente come U,S. L'addività ci consente di esprimere tali grandezze in funzione del numero di particelle del sistema termodinamico in istudio. Senza perdita di generalità, consideriamo un sistema composto da N particelle identiche (atomi o molecole). Prendiamo l'energia interna che per quanto precede è U(S,V) dove S,V sono additive. Immaginando il sistema come l'unione di un numero arbitrario r di sottosistemi si ha che per ciascuno di essi l'energia interna è
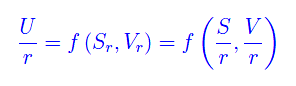
Segue
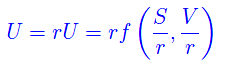
Per r=N
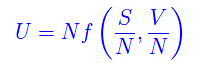
Allo stesso modo per l'energia libera F(U,T):
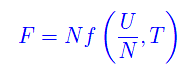
giacché queste relazioni valgono all'equilibrio termodinamico, per cui la temperatura è ovunque la stessa. Qui f è ovviamente una funzione diversa da quella che definisce l'energia interna. E quindi per l'entalpia
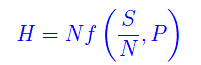
in quanto il sistema ha raggiunto l'equilibrio => P=costante. Infine, il potenziale termodinamico
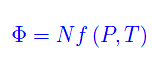
Cosa succede se il sistema scambia particelle con l'ambiente? Cioè, se non conserva il numero di particelle? Non dobbiamo fare altro che aggiungere un termine proporzionale a dN nelle varie forme differenziali. Ad esempio
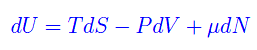
da cui abbiamo una nuova variabile termodinamica
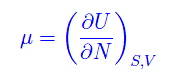
che si chiama potenziale chimico. La denominazione è ovvia perché richiama le reazioni chimiche (dove il numero di particelle è variabile). Dalla definizioneo segue che il potenziale chimico misura l'energia acquisita/persa per l'aggiunta/rimozione di una particella dal/al sistema. Segue
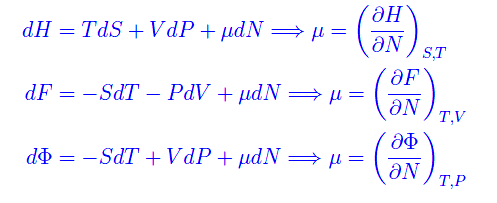
Per il potenziale termodinamico
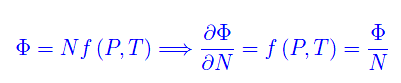
da cui
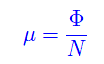
Cioè il potenziale chimico è il potenziale termodinamico di singola particella. Esprimendolo in funzione di P,T si trova
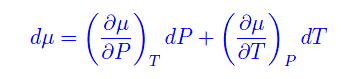
Cioè
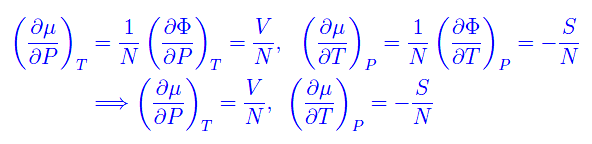
Dalla
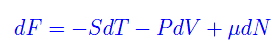
per V=costante
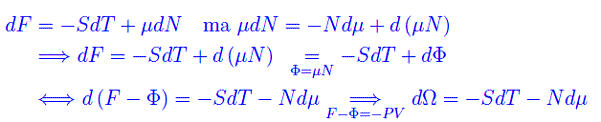
avendo definito un nuovo potenziale (gran potenziale) Ω=-PV. Quindi
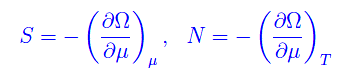
Se V=costante
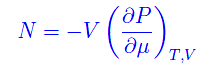


 Congettura di Riemann
Congettura di Riemann Trasformata discreta di Fourier
Trasformata discreta di Fourier
 Trasformata di Fourier nel senso delle distribuzioni
Trasformata di Fourier nel senso delle distribuzioni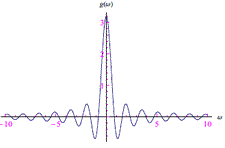 Trasformata di Fourier
Trasformata di Fourier  Infinitesimi ed infiniti
Infinitesimi ed infiniti Limiti notevoli
Limiti notevoli Punti di discontinuità
Punti di discontinuità Misura di Peano Jordan
Misura di Peano Jordan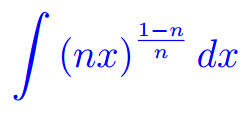 Eserciziario sugli integrali
Eserciziario sugli integrali Differenziabilità
Differenziabilità  Differenziabilità (2)
Differenziabilità (2) Esercizi sui limiti
Esercizi sui limiti Appunti sulle derivate
Appunti sulle derivate Studio della funzione
Studio della funzione Esercizi sugli integrali indefiniti
Esercizi sugli integrali indefiniti Algebra lineare
Algebra lineare Analisi Matematica 2
Analisi Matematica 2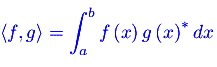 Analisi funzionale
Analisi funzionale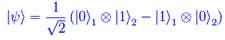 Entanglement quantistico
Entanglement quantistico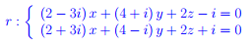 Spazio complesso
Spazio complesso Biliardo di Novikov
Biliardo di Novikov Intro alla Meccanica quantistica
Intro alla Meccanica quantistica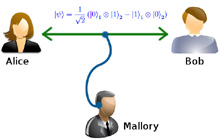 Entanglement Quantistico
Entanglement Quantistico