Legge di Joule (Termodinamica)
Gennaio 12th, 2022 | by Marcello Colozzo |
Definizione
Dicesi espansione libera di un sistema termodinamico, una trasformazione determinata da un incremento della variabile estensiva «volume», per la quale il sistema non compie lavoro attraverso le forze di pressione.
Consideriamo, in particolare, l'espansione libera di un gas nell'esperimento di Joule illustrato in fig. 1, dove A,B sono due recipienti immersi in un bagno termico D e che possono comunicare attraverso un rubinetto C.
All'istante iniziale t=0 il recipiente A è riempito di gas, mentre B è vuoto, e il sistema A+B+D è in equilibrio a una temperatura T. Quindi apriamo C lasciando espandere (liberamente) il gas nel recipiente B. Joule osservò che tale processo di espansione è con buona approssimazione isotermo. Incidentalmente, Joule utilizzò un gas reale sufficientemente rarefatto. In seguito a successive esperienze ripetute in collaborazione con Kelvin, si constatò che nel limite delle grandi rarefazioni (gas perfetti), il predetto processo è isotermo. Vediamo cosa può dirci il primo principio della termodinamica:

Avendo un'espansione libera, è δL=0, ma è anche δQ=0 in quanto il sistema è termicamente isolato. Dunque dU=0. Rammentiamo che nel caso di un gas è U=U(T,V):

Per quanto precede, il processo è isotermo:

che esprime matematicamente la Legge di Joule>: L'energia interna di un gas perfetto è indipendente dal volume.
Osservazione
È in tal modo giustificata l'asserzione secondo cui un gas perfetto è un trasformatore ideale di energia.
Quindi per un gas perfetto è U=U(T), onde per una trasformazione libera a volume costante

Se ci riferiamo all'unità di massa, abbiamo per il calore specifico a volume costante

cioè la derivata della funzione energia interna U(T).
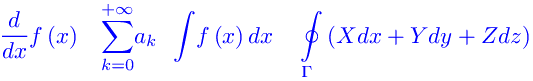


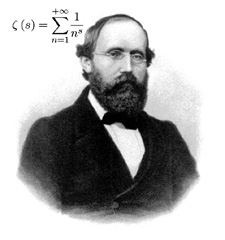 Congettura di Riemann
Congettura di Riemann Trasformata discreta di Fourier
Trasformata discreta di Fourier
 Trasformata di Fourier nel senso delle distribuzioni
Trasformata di Fourier nel senso delle distribuzioni Trasformata di Fourier
Trasformata di Fourier  Infinitesimi ed infiniti
Infinitesimi ed infiniti Limiti notevoli
Limiti notevoli Punti di discontinuità
Punti di discontinuità Misura di Peano Jordan
Misura di Peano Jordan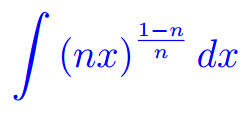 Eserciziario sugli integrali
Eserciziario sugli integrali Differenziabilità
Differenziabilità  Differenziabilità (2)
Differenziabilità (2) Esercizi sui limiti
Esercizi sui limiti Appunti sulle derivate
Appunti sulle derivate Studio della funzione
Studio della funzione Esercizi sugli integrali indefiniti
Esercizi sugli integrali indefiniti Algebra lineare
Algebra lineare Analisi Matematica 2
Analisi Matematica 2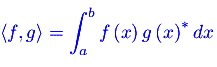 Analisi funzionale
Analisi funzionale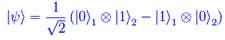 Entanglement quantistico
Entanglement quantistico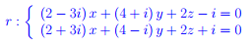 Spazio complesso
Spazio complesso Biliardo di Novikov
Biliardo di Novikov Intro alla Meccanica quantistica
Intro alla Meccanica quantistica Entanglement Quantistico
Entanglement Quantistico